Probablemente la mayoría de vosotros habréis escuchado alguna vez propaganda que recomienda inflar los neumáticos de vuestro vehículo particular con
nitrógeno en vez de aire normal. Pero ¿realmente es beneficioso? ¿O es un engañabobos pensado para extraernos los euros que tanto nos cuesta ganar?
En este miniserie de artículos analizaremos las diferentes afirmaciones que se pueden encontrar acerca del tema, y veremos que dice la Física sobre cada una de ellas.
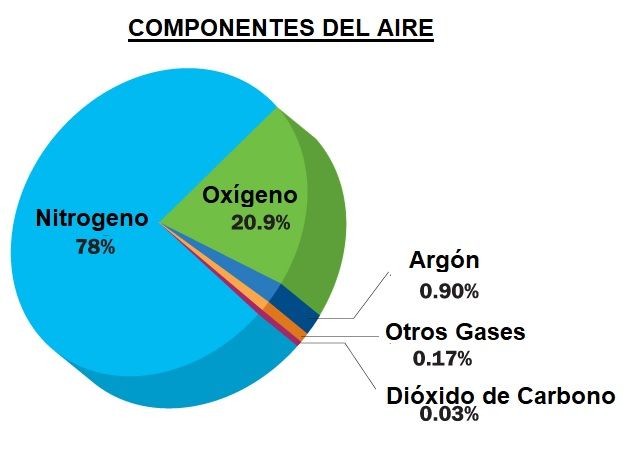
Recordad que el aire natural, el que respiramos constantemente,
ya es en su mayor parte nitrógeno (78%), mientras que el resto es
oxígeno (21%) y trazas de otras substancias (argón, dióxido de carbono, etc.). Así que cuando decimos «inflar con nitrógeno» en realidad
la diferencia radica únicamente en el 22% restante, poco más de una quinta parte.
La mayoría de los argumentos en favor del nitrógeno se basan en que «
las moléculas de nitrógeno son más grandes que los de oxígeno». Esto es cierto, pero debemos matizar. En la naturaleza, tanto los átomos de ambos elementos no se encuentran por separado, siempre van de dos en dos. Es decir, en el aire no tenemos átomos de nitrógeno y de oxígeno, si no que tenemos un montón de parejas de átomos de nitrógeno, N2 y otro montón (más pequeño) de parejas de oxígeno, O2.
En realidad, la distancia entre dos átomos en una molécula no es algo tan obvio como la distancia entre dos objetos macroscópicos. Hay diferentes métodos de definir esta distancia, y cada uno da diferentes resultados (y todos esos resultados son correctos, corresponden a definiciones diferentes). Yo me voy a centrar en lo que se llama
radio covalente, ya que es la definición que tiene en cuenta el enlace químico.
El diámetro covalente de una molécula de nitrógeno de
146 picometros, mientras que el del oxígeno es
132pm. Ojo, en algunos sitios encontraréis medidas en micras; eso es incorrecto, un millón de picometros es una micra, así que en realidad las molećulas son mil veces más pequeñas de lo que aparece en algunos panfletos.
Como veis,
la diferencia es muy pequeña, apenas del 7%. Por lo tanto, es de esperar que cualquier mejora que exista al usar nitrógeno sea más o menos de esa magnitud. Pero eso sería si llenáramos una rueda de oxígeno puro. Recordad que apenas una quinta parte del aire es oxígeno, así que en realidad el efecto se vería reducido en esa proporción. Así que, por lógica,
si (condicional) el tamaño de las moléculas importara, el efecto sería del 1,4% (siete dividido entre cinco). Este
posible efecto, sin ser nimio, sí que es bastante menor del publicitado.
Ahora bien, nos preguntaremos si realmente el tamaño de la molécula supone una ventaja real. A esto, los teólogos del nitrógeno puro suelen aportar los siguientes motivos.
Como el nitrógeno es más grande, le costará más atravesar las fibras del neumático, y por lo tanto el ritmo de pérdida de presión será menor.
Esta afirmación parece muy obvia, pero esconde
una pequeña trampa. Recordad que la distancia que hemos dado es la distancia entre los átomos de una molécula. Las moléculas más o menos una mancuerna, como la que vemos en la imagen anterior. Los pesos serían los átomos, mientras que la mancuerna en si sería el enlace químico.
Lo que estamos diciendo que la mancuerna que une los átomos de nitrógeno es algo más larga que la que une los átomos de oxígeno. Ahora bien, si tuvierais que pasar esas mancuernas por una puerta estrecha, ¿lo haríais pasando de frente, de forma que las pesas chocaran contra el marco?
¿O bien la girarías para pasarla longitudinalmente?
Sin duda, una mancuerna algo más corta podrá maniobrar más fácilmente entre las estrechas fibras de la goma, pero el efecto no será tan importante como podíamos pensar al principio. En definitiva, no apreciaremos gran diferencia en el ritmo de pérdida de presión debido a este fenómeno.
Como las moléculas de nitrógeno son mayores, llenan mejor el interior del neumático.
Esto es completamente irrelevante. El gas no se mete en la rueda para que llene su interior (como si metiéramos agua), sino para que ejerza presión. Y la presión no se ejerce llenando un recipiente, sino colisionando contra las paredes del mismo.
En primer lugar, hay que tener en cuenta que las moléculas son realmente pequeñas. A una presión de dos atmósferas, a unos 25ºC,
el volumen que ocupan todas las moléculas del gas juntas es unas quince mil veces menor al del recipiente que lo contiene. Es decir, si las moléculas de repente se quedaran quietas y cayeran todas al fondo de la rueda, ocuparían un espacio 15.000 veces más pequeño que el neumático en si.
Sin embargo, pese a ser tan pequeñas, se mueven muy rápido, a una velocidad media de 1800km/h. Por lo tanto, cuando llegan a la cubierta de la rueda, producen
colisiones muy fuertes. Esas colisiones son las que proporcionan la presión al neumático. Y en este proceso
el tamaño concreto de la molécula no importa para nada. Lo único que importa es que haya la cantidad suficiente de moléculas.
Como veis, las cosas pintan mal para el nitrógeno. Pero aun hay más argumentos que se suelen escuchar al respecto. Los veremos en el próximo artículo.
En el capítulo anterior analizamos desde el punto de vista físico unos cuantos argumentos que se suelen esgrimir en favor de
inflar las ruedas de nuestros vehículos con nitrógeno puro, en vez de con aire normal.
Hasta ahora nos hemos centrado, sobre todo, en los argumentos que tienen que ver con
el diferente tamaño de las moléculas que forman los gases de nitrógeno y oxígeno. No obstante, vimos que algunos de estos argumentos no tienen fundamento físico; y los que lo tienen
no parecen suficientemente significativos como para justificar los beneficios que se suelen atribuir a esta práctica.
Hoy seguiremos con el análisis, viendo aspectos químicos, termodinámicos y psicológicos.
El nitrógeno es un gas inerte, que no estropea ni la llanta ni el neumático.
Que una substancia sea inerte significa que, cuando entra en contacto con otras,
no produce reacciones químicas. El nitrógeno está lejos de ser inerte. Por poner un ejemplo, un 3% de la masa de un cuerpo humano está formada por nitrógeno; es un elemento fundamental para la estructura del ADN y de las proteínas. Si el nitrógeno no pudiera participar en reacciones químicas, la vida no sería posible.
Lo que si es cierto es que el aire normal contiene oxígeno, que es
el segundo elemento más reactivo que existe (por detrás del flúor). Sin ir más lejos, es un gran oxidante. Por lo tanto, utilizar nitrógeno en vez de aire ambiental puede reducir la oxidación de la parte del interior del neumático y de la parte de la llanta que queda en contacto con el interior de la rueda.
Sin embargo, la mayor parte de la llanta en si y el neumático
siguen estando en contacto con el aire y las inclemencias meteorológicas, así que cuesta de imaginar que una rueda llegue al final de su vida útil debido al desgaste ocurrido en el interior y no en el exterior. Además, hoy en día tenemos otras formas de evitar la oxidación (uso de materiales inoxidables, pinturas antióxido, etc.).
Por lo tanto, aunque esta afirmación sí tiene fundamento científico, la verdad es que
preocuparse por esto parece matar moscas a cañonazos.
Por cierto, según la
wikipedia,
el nitrógeno es el tercer elemento más reactivo, justo por detrás del oxígeno.
El nitrógeno se calienta menos, por lo que la presión permanece más constante.
Debo reconocer que esta afirmación me turba un poco. La he leído en tantos sitios diferentes que casi empiezo a dudar de lo que aprendí en la facultad de Física.
En primer lugar,
todos los gases cuando se encuentran en bajas presiones (y, para lo que la Física respecta, la presión a la que se inflan los neumáticos es baja) siguen de forma muy aproximada lo que llamamos
comportamiento ideal. Así que no importa lo más mínimo la composición del gas, su comportamiento termodinámico sería el mismo.
Pero alguien podría argumentar que, como he dicho, esto es
una aproximación, lo cual significa que dará resultados muy similares a los reales, pero no es preciso al 100%. Es decir, diferentes gases podrían tener comportamientos
un poco diferentes.
Pero, ¿cuánto es un poco? Veámoslo. De nuevo, según la wikipedia, a 25ºC la
capacidad calorífica del nitrógeno es 29,124 J mol−1 K−1, es decir que para elevar un grado la temperatura de un mol de nitrógeno (un mol es la cantidad de gas que contiene 6.02214179 · 1023moléculas) es necesario aportar poco menos de 30 julios de energía. Por otra parte,
la capacidad calorífica específica del oxígeno es 29.378 J mol−1 K−1.
Como veis, efectivamente los números son muy similares, la diferencia es únicamente del 0,8%. Pero, además, para elevar un grado la temperatura del oxígeno hace falta más energía. Así que si una cantidad equivalente de nitrógeno y oxígeno absorben la misma energía,
el oxígeno se calentará menos.
Así que, o bien hay algo gordo que yo me pierdo, o esta afirmación es
rotundamente falsa. En cualquier caso, la diferencia es ínfima, tal y como predice la aproximación de gas ideal.
A mi me inflaron las ruedas con nitrógeno, y ahora mi coche va suave como el culito de un bebé.
Aunque las valoraciones subjetivas de este tipo constituyen la forma más poderosa de
marketing que existe, el boca-oreja,
carecen de valor científico. Es el
efecto placebo: simplemente por saber que nos han hecho algo que promete ser beneficioso, automáticamente creemos notar dicha mejora.
Además, cualquier aumento en la presión de los neumáticos, ni que la «rallita» del manómetro que se pierde cada mes o dos, tiene un ligero efecto en el
feeling del conductor. Si nos acaban de vender las excelencias del nitrógeno, probablemente
pensaremos que el cambio es debido a la pureza del gas.
Para eliminar el efecto placebo del asunto sería imprescindible hacer un
ensayo ciego. Es decir, tomar una amplia muestra de conductores, decirles a todos que le vamos a inflar las ruedas con nitrógeno, pero hacerlo únicamente con la mitad de ellos. La otra mitad es el grupo de control, aunque creen que vamos a usar nitrógeno, inflamos sus ruedas con aire corriente y moliente. Si las conclusiones de ambos grupos son similares, sabremos que no hay una mejora real, sino que es puramente un efecto psicológico.
Hoy terminaremos nuestro análisis
científico de los argumentos que se suelen esgrimir en favor de inflar las ruedas de nuestro vehículos con nitrógeno puro.
Los bólidos de la Fórmula 1 hinchan sus ruedas de alto rendimiento con nitrógeno. Por algo será.
En tres palabras:
no es cierto. Al contrario de lo que se suele argumentar, en competición el uso de nitrógeno no es común ni mucho menos. Por lo contrario, se suele utilizar
aire deshumidificado. Los propios representantes de
Michelín confirmaron este extremo al ser contactados por los editores de
Circula seguro para comunicarles la intención de publicar estos de artículos. Y los de
Michelín, algo saben de
neumáticos y competición.
El aire deshumidificado se utiliza principalmente por dos motivos: en primer lugar, para cuidar los delicados compuestos utilizados en competición. Fijaos que, aunque se toman la molestia de retirar la humedad,
la presencia de oxígeno no les molesta demasiado. Será que no perjudica tanto.
Por otro lado, el comportamiento del vapor de agua (humedad en el aire) es
muy alejado del de un gas ideal, lo que dificulta controlar la presión al aumentar la temperatura. Y, recordemos, las ruedas de competición alcanzan temperaturas muy superiores a las habituales en la circulación pública.
El oxígeno es deflagrante, por lo que su presencia puede provocar incendios.
Hombre, no todo iba a ser mentira. Esto es cierto,
el oxígeno es un ingrediente indispensable para que se produzca la combustión. Además, la goma del neumático es bastante inflamable.
Pero con la presencia de oxígeno y de un material inflamable no es suficiente. Si fuera suficiente con esto, las ruedas arderían espontáneamente (y la madera,… y cualquier otro material que no sea ignífugo). Hace falta una chispa que inicie la deflagración. En este caso, la única chispa posible es la temperatura que alcance el interior de la rueda.
Ahora bien, la temperatura que alcanzan las ruedas de un coche normal, e incluso las de un vehículo de competición, está
lejos de ser suficiente para provocar la auto-ignición del neumático. ¿A caso habéis visto algún vehículo con las ruedas ardiendo simplemente por ir muy rápido? (Excepto el De Lorean de McFly).
El peligro de deflagración de una rueda por contener oxígeno únicamente existirá en ruedas sometidas a condiciones realmente extremas, como por ejemplo en
aviones o
ferrocarriles sobre neumáticos de goma (¿deberíamos llamarlos
gomacarriles?). Este es el
único caso en que es realmente justificable la necesidad de usar nitrógeno puro.
Inflar las ruedas con nitrógeno es muy barato.
Este punto es bastante
subjetivo. Buscando por internet, he encontrado la tarifa de un servicio rápido: 3,75€ por rueda. No parece un dineral, pero hay que tener en cuenta que los supuestos beneficios del nitrógeno únicamente persisten si cada vez que se revisa la presión se hace en nitrógeno, por lo que a la larga tendremos que desembolsar unos cuantos euros cada pocos meses.
Eso sí, algunos talleres tienen la
decencia bondad de incluir las sucesivas revisiones en el precio inicial. Aunque de esa forma se aseguran que visitemos el taller, en vez de una simple gasolinera, con la posibilidad de que nos tienten con otros servicios.
El nitrógeno en sí es extremadamente barato. De hecho, es un residuo de algunos procesos industriales (por ejemplo, al embotellar oxígeno para uso médico o en submarinismo), por lo que se obtiene de forma gratuita como subproducto. No quiere decir que después la planta embotelladora lo regale, pero sí lo venden extremadamente barato. Es como si a mi me pagaran por mi sudor.
Algunos talleres utilizan
máquinas que filtran el nitrógeno directamente del aire utilizando un proceso de ósmosis inversa, por lo que no deben pagar absolutamente nada por la materia primera. Por lo que he visto en internet, estas máquinas cuestan del orden de dos o tres mil euros, por lo que según la tarifa anterior se amortizan al tratar 200 coches (sin contar las ruedas de repuesto).
No podemos terminar esta disquisición sobre el precio del nitrógeno puro sin hacer notar que
la alternativa es gratuita. La práctica totalidad de las gasolineras tienen compresores de aire donde cualquier conductor puede detenerse y comprobar la presión de sus neumáticos sin esfuerzo ni gasto alguno.
Conclusiones
A lo largo de estos tres artículos hemos analizado un buen número de argumentos que se suelen escuchar respecto al inflado de las ruedas con nitrógeno. Hemos visto que con el libro de Física en la mano, la mayoría de estos argumentos son
falsos, incluso alguno es realmente ridículo. Además, los pocos que sí tienen algún fundamento científico producen un
efecto muy pequeño, casi imperceptible.
A partir de aquí, que cada cual saque sus propias conclusiones y gaste su dinero en lo que considere oportuno. En cualquier caso, uses nitrógeno, aire ambiental o humo de tabaco, lo único que te pido es que
revises la presión de tus ruedas con regularidad.
fuente:
http://www.circulaseguro.com/vale-la-pena-inflar-las-ruedas-con-nitrogeno-1/